W grudniu 2019 roku w mieście Wuhan w Chinach, pojawiły się pierwsze przypadki nietypowej postaci zapalenia płuc. Po kilkunastu dniach intensywnych badań udało się zidentyfikować czynnik etiologiczny, którym okazał się nieznany wcześniej betakoronawirus, nazwany później SARS‑CoV‑2, odpowiedziany za chorobę COVID‑19. Epidemia bardzo szybko rozprzestrzeniła się na całym świecie, przyjmując skalę pandemii.
Błyskawicznie rozpoczęto prace nad testami diagnostycznymi, wykrywającymi SARS-CoV-2. Obecnie w diagnostyce zakażenia złoty standard stanowią metody molekularne z zastosowaniem metody PCR w czasie rzeczywistym (RT-PCR), bazujące na amplifikacji materiału genetycznego wirusa. Technika ta odznacza się wysoką swoistością i czułością, a także możliwością wykrycia zakażenia we wczesnej fazie. Mimo wielu zalet, RT-PCR ma również swoje ograniczenia. Popeł- niane błędy podczas pobierania, przechowywania czy transportu próbek, a także pojawianie się nowych wariantów wirusa może spowodować uzyskanie wyniku fałszywie ujemnego. Co więcej, istnieje możliwość pojawienia się wyniku wątpliwego, który wymaga powtórzenia badania, co wydłuża czas diagnostyki. Możliwe jest także długotrwałe utrzymywanie się wyników dodatnich, pomimo ustąpienia objawów klinicznych COVID-19. Wobec pojawiających się problemów diagnostycznych, ko- nieczny jest rozwój innych metod, które mogłyby wspomóc standardową diagnostykę.
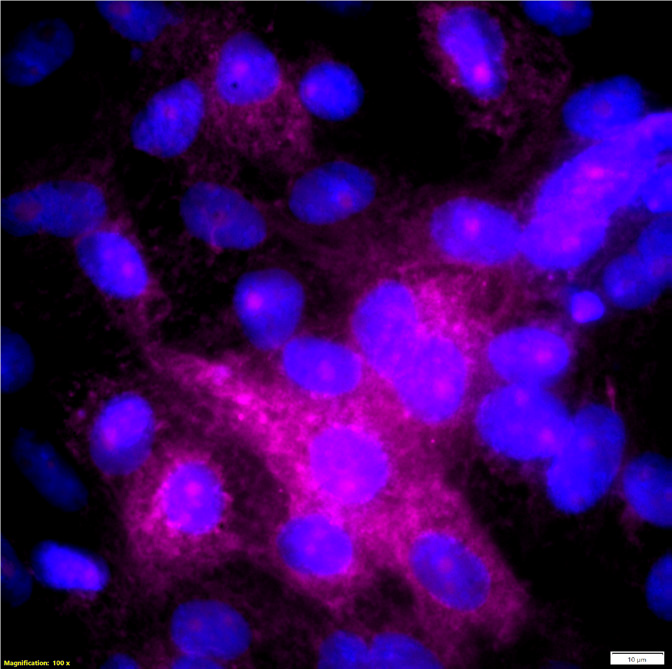
Przykładowe zdjęcie preparatu klinicznego z komórkami zakażonymi wirusem SARS‑CoV‑2. Widoczna różowa fluorescencja (nałożony obraz czerwonej i niebieskiej) pochodząca od replikującego wirusa SARS‑CoV‑2 w cytoplazmie komórek nabłonka. Pow. 100x (Olympus BX63).
Opracowana przez zespół badawczy z Zakładu Molekularnej Mikrobiologii Medycznej, Wydziału Lekarskiego UJ CM metoda detekcji SARS-CoV-2 w ramach realizacji projektu pt. „Modele wielospecjalistycznej opieki szpitalnej i pozaszpitalnej nad pacjentem z zakażeniem SARS‑CoV‑2” finansowanego ze środków Narodowego Centrum Badań i Rozwoju w ramach naboru „Wsparcie szpitali jednoimiennych”, umowa nr SZPITALE EDNOIMIENNE/18/2020, bazuje na detekcji wirusa przy użyciu ftuorescencyjnej hybrydyzacji in situ (FISH). Jest to technika służąca do wykrywania określonej sekwencji RNA czy DNA bezpośrednio w materiale biologicznym, za pomocą znakowanych ftuorescencyjnie sond. Specjalnie zaprojektowane sekwencje sond poddawane są hybrydyzacji z badanym materiałem biologicznym (wymaz z nosogardzieli), w którym poszukiwane są sekwencje markerowe wirusa, a następnie preparat jest oceniany pod mikroskopem ftuorescencyjnym. Zastosowane sondy są znakowane czerwonym barwnikiem ftuorescencyjnym, co powoduje, że w obrazie mikroskopowym uwidaczniają się wiecące na czerwono lub różowo obszary w komórkach zainfekowanych wirusem.
Opatentowana przez zespół badawczy UJ CM nowa metoda jest mniej wrażliwa na błędy przedlaboratoryjne, czy czynniki związane z niewłaściwym transportem i przechowywaniem próbek, ponieważ odmiennie niż w PCR, FISH nie wymaga dostępnych stabilnych i kompletnych długich sekwencji RNA, a wystarczają krótkie, kilkunastonukleotydowe, które są znacznie bardziej stabilne. Co więcej, metoda ta umożliwia wizualizację zakażenia komórki wirusem SARS-CoV-2, co znacząco ogranicza występowanie rezultatów fałszywie dodatnich, które stanowią problem w przypadku testów serologicznych RT–PCR. Zastosowanie jednej uniwersalnej sondy do wyznakowania różnych sekwencji oligonukleotydów komplementarnych do wielu miejsc w genomie SARS-CoV-2 znacząco zmniejsza koszty, ponieważ nie zachodzi konieczność syntezy każdej sondy znakowanej osobno. Co istotne, metoda znacząco ogranicza sytuacje, w których zakażenie nie jest wykrywane z powodu mutacji wirusa (zastosowanie wielu różnych sekwencji sond jednocześnie), dlatego w przypadku nowych wariantów SARS-CoV-2, możliwa będzie ich detekcja bez konieczności ciągłej modyfikacji metody.
Ochroną prawną wyżej opisanego wynalazku Uniwersytetu Jagiellońskiego i kompleksową współpracą nauki z otoczeniem zajmuje się Centrum Transferu Technologii CITTRU.
Obecnie Uniwersytet Jagielloński wraz z zespołem naukowym pod kierunkiem Pana prof. dr hab. Tomasza Gosiewskiego poszukuje podmiotów zainteresowanych komercyjnym wykorzystaniem opisanego rozwiązania i współpracą w niniejszym zakresie tematycznym.
Mikroskop fluorescencyjny wykorzystany w badaniach zakupiono przy wsparciu finansowym Priorytetowego Obszaru Badawczego qLIFE w ramach Programu Strategicznego Inicjatywa Doskonałości w Uniwersytecie Jagiellońskim.
mgr inż. Agnieszka Krawczyk,Zakład Molekularnej Mikrobiologii Medycznej, Wydział Lekarski UJ CM
dr Klaudia Polakowska, Centrum Transferu Technologii CITTRU
dr Dominika Salamon, Zakład Molekularnej Mikrobiologii Medycznej, Wydział Lekarski UJ CM
dr Agnieszka Sroka‑Oleksiak, Zakład Molekularnej Mikrobiologii Medycznej, Wydział Lekarski UJ CM
dr Katarzyna Talaga‑Ćwiertnia Zakład Molekularnej Mikrobiologii Medycznej, Wydział Lekarski UJ CM
prof. dr hab. Monika Brzychczy‑Włoch Zakład Molekularnej Mikrobiologii Medycznej, Wydział Lekarski UJ CM
prof. dr hab. Tomasz Gosiewski, Zakład Molekularnej Mikrobiologii Medycznej, Wydział Lekarski UJ CM



